Если бы десятиклассный я услышал фразу «строение атома для экзамена ЕГЭ по химии», он бы тихо застонал. Тогда всё это казалось набором страшных терминов и кругами на орбитах, как у Сатурна. Сейчас, спустя годы, я объясняю эту тему спокойно, даже с удовольствием — и, надеюсь, заразительно. Ничего мистического в атоме нет: просто нужно понять логику, запомнить структуру и пару закономерностей, которые потом сами начнут складываться в голове.
Почему вообще важно понимать строение атома
На ЕГЭ по химии строение атома — фундамент. Это не просто «одна из тем», а ключ к половине заданий. Если ты не знаешь, где у атома электроны и какой у него заряд, ты не сможешь правильно расставить коэффициенты, определить тип связи или предсказать реакцию. Без базы о моделях атома вся химия превращается в угадайку. Когда я готовился сам, постоянно ловил себя на том, что путаю протоны с нейтронами. Тогда я нарисовал себе схему и повесил над столом: круг (ядро), в нем шарики — и стрелочки с подписями. Работает до сих пор. Помогает даже студентам, с которыми я занимаюсь уже как репетитор.
Из чего состоит атом: ядро и электронная оболочка
Каждый атом — это миниатюрная солнечная система. В центре ядро, вокруг кружатся электроны. В ядре — протоны с положительным зарядом и нейтроны без заряда. Их общее количество определяет массу атома. Электроны находятся в постоянном движении вокруг ядра, занимая строго определенные уровни, или энергетические оболочки. Количество электронов всегда равно числу протонов, если атом нейтрален. Меня в свое время удивило, насколько это логично: баланс зарядов сохраняет устойчивость. Иногда ученики спрашивают: «А что, они реально крутятся?» — не совсем, их движение скорее похоже на облако, где вероятность найти электрон выше в определенной зоне. Красиво и, что удобно, удобно для расчетов.
Как появились модели строения атома
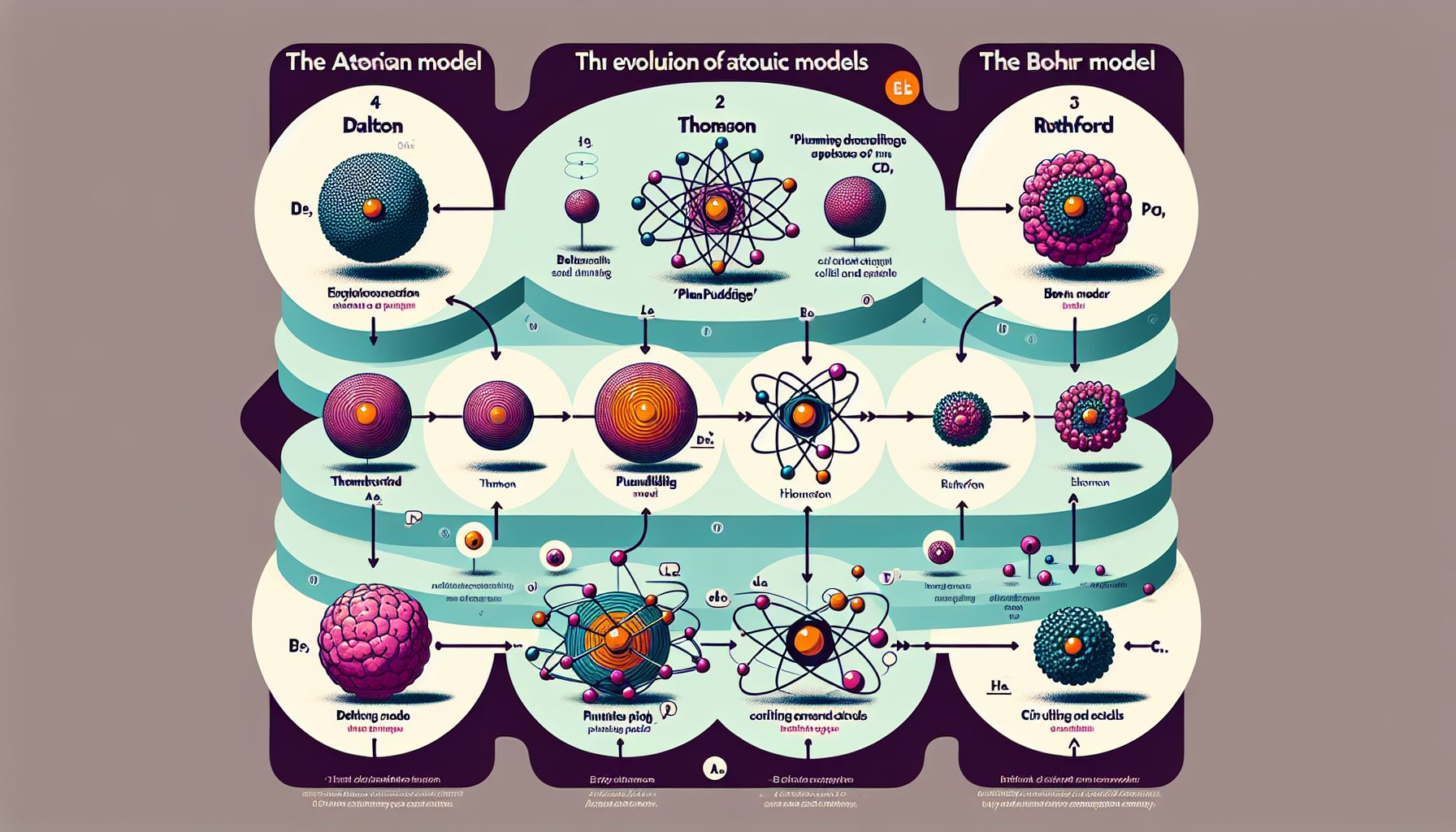
Путь от идеи до современной модели занял больше века. Сначала был модель Джона Дальтона: атом как неделимая частица, шарик и всё. Потом Томсон предложил «пудинг с изюмом» — электрончики встроены в положительно заряженное тесто. Миленько, но не работает. Затем пришел Резерфорд и показал: ядро — плотное, а электроны где-то снаружи. Боровская модель уточнила энергию орбит, а квантово-механическая описала уже вероятности нахождения электронов. Важно понимать: эти модели — не ошибка одна другой, а ступени понимания. Следующему поколению нужен был язык более точный, чем точки и кружочки.
Электронные уровни и подуровни
Электроны располагаются по энергетическим уровням, и порядок их заполнения описывается схемой Клечковского. Правило простое: «сначала меньшая сумма n+l, потом по меньшему n». На практике это значит, что уровень 4s заполняется раньше 3d. Запомнить несложно, если нарисовать диагонали, и да, это момент, где половина учеников обычно морщит лоб. Пример: у натрия 11 электронов, значит, конфигурация 1s²2s²2p⁶3s¹. Вижу, как многие на этом месте просто отказываются верить, что это можно держать в памяти, но стоит пару раз прорешать подобные задания — и всё ложится. Главное — сверяться с периодической таблицей и не путать блоки s, p, d и f.
Зачем нужны квантовые числа

Квантовые числа — это адрес каждого электрона. Есть главное (n), орбитальное (l), магнитное (m) и спиновое (s). Они описывают уровень, форму орбитали, ориентацию в пространстве и направление вращения. Четыре числа, а информации — на целую вселенную. В сборниках для ЕГЭ это часто подается сухо, но если воспринимать как игру — легче. Представь, что электрон заполняет анкету: где он живет, какую форму орбиталей предпочитает и в какую сторону «крутится». Так мозг запоминает структуру быстрее. Признаться, в своё время я тоже путал спины, но мне помогла простая ассоциация: стрелочки вверх-вниз — будто два электрона в одной паре туфель, которые могут стоять только носками в разные стороны.
Как строение атома связано с химическими свойствами
Самое интересное начинается здесь. Газ благороден не потому, что так назвали, а потому, что его электронные уровни полностью заполнены. Щелочные металлы наоборот, имеют один электрон на внешнем уровне — и мгновенно его отдают. Это и есть причина их бешеной активности. Понимание распределения электронов объясняет, почему кислород жадно «тянет» электроны, а инертные газы стоят в стороне и никому не мешают. Вспоминаю студента, который однажды спросил: «Можно просто выучить реакции и не мучиться с атомами?» Можно, конечно, но это будет как изучать песни, не понимая нот. Для осознанного уровня — без строения атома никуда.
Как эффективно готовиться к теме строения атома

Когда я готовился сам, мне помог четкий план. Попробуй такой порядок:
- Прочитать теорию в учебнике и пометить непонятные места.
- Нарисовать схемы строения атомов первых 20 элементов.
- Решить минимум 20 заданий из ЕГЭ части 1 на эту тему.
- Пройти онлайн-тест, чтобы проверить, где «пробелы».
- Повторить через день — и закрепить от руки.
Важно не только учить, но и применять. Делая задания, думай: почему так? Это сэкономит баллы на экзамене. Если чувствуешь, что запутался, не страшно — мозг просто перестраивает связи. После пары вечеров с таблицей Менделеева вдруг приходит ясность. И да, если хочется выстроить системную подготовку и не тратить время на хаотичные попытки, посоветую онлайн курс подготовки к ЕГЭ — там объясняют простыми словами и дают реальную практику.
Типичные ошибки и как их избежать
Ох, мой любимый раздел. Ошибки — верные спутники каждого, кто начинает. Часто вижу: ребята путают число протонов и порядковый номер элемента. Второй фаворит — «забытые» электроны на подуровнях. Еще одна частая беда — механическое заучивание, без понимания логики. Чтобы с этим справиться, я советую вести «дневник непонятных мест» и возвращаться к ним через несколько дней. Поверь, мозг успевает осмыслить материал глубже. И не спорьте с таблицей Менделеева — она всегда права.
Понимание строения атома — не заклинание из учебника, а живой инструмент. От него зависят формулы, типы связей и химические свойства. Чем лучше понимаешь этот микромир, тем увереннее решаешь задачи и тем спокойнее идешь на экзамен. Ну а если что-то не выходит с первого раза — просто помни: даже электрон перед тем, как «устроиться» в орбиталь, ищет свое место.